Un elettrocardiogramma da brividi

A cura di Giovanni Tavecchia
S.C. Cardiologia I – Emodinamica
Sono le 11 di mattina, è una giornata uggiosa di fine novembre, il Pronto Soccorso è pieno di pazienti da ricoverare e il cicalino squilla in continuazione. Tre giorni prima, una ragazza di 21 anni è stata ricoverata in Terapia Intensiva dopo un incidente in motorino che le ha provocato fratture multiple al bacino e agli arti inferiori. È sedata, intubata e con dei fissatori esterni nelle gambe.
Tra le tante chiamate ricevute, c’è quella dei Rianimatori che ci chiedono di valutare urgentemente proprio quella ragazza. Dicono che il quadro clinico si è aggravato in maniera improvvisa, l’emodinamica è diventata instabile, l’ECG sembra quello di uno STEMI anteriore e la paziente non è più contattabile alle finestre neurologiche.
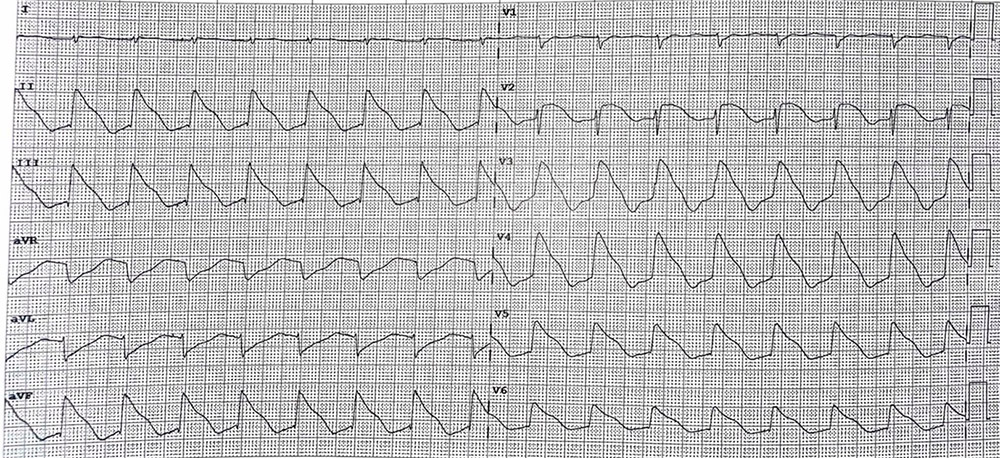
Corriamo in Rianimazione e già nel tragitto le nostre teste iniziano a pensare a cosa potrebbe essere successo. Appena varchiamo la soglia della Terapia Intensiva, ci mostrano l’ECG. Il tracciato, drammaticamente modificato rispetto all’ingresso, è caratterizzato da un ritmo giunzionale accelerato con diffuso e marcato sopraslivellamento del tratto ST che si fonde con il QRS e con l’onda T (Figura 1-2). È un quadro del tutto inusuale che ci lascia a bocca aperta.
I rianimatori ci riferiscono che il giorno precedente, dopo aver eseguito una TC con mezzo di contrasto iodato, la paziente aveva sviluppato un quadro di shock anafilattico caratterizzato da ipotensione, tachicardia e rash cutaneo. L’episodio era stato trattato efficacemente con steroide endovenoso e “boletti” di noradrenalina.
Agli esami ematochimici gli elettroliti, l’emocromo e la funzionalità epato-renale sono nei limiti. Al contrario, gli enzimi di danno muscolare sono marcatamente alterati con CPK superiori a 40.000 UI/L e mioglobina intorno a 15.000 µg/L. La troponina T è lievemente aumentata con valori di TnT-HS di 86 ng/L (vn < 15 ng/L). Clinicamente la paziente non presenta tensione delle logge muscolari e una sindrome compartimentale sembra poco probabile.
Pronti via, sonda in mano alla caccia di qualche indizio. Il ventricolo sinistro non è dilatato, la cinesi è nei limiti, la funzione globale intorno al 55%, il ventricolo destro è piccolo e normocinetico, le valvole e l’aorta non presentano alterazioni, di versamento pericardico non c’è traccia. L’unico dato fuori posto è un lieve aumento dello spessore della parete infero-laterale (11-12 mm). Nel sospetto di un’eventuale embolia grassosa paradossa, coronarica e/o cerebrale, realizziamo anche un ecocardiogramma transesofageo che esclude passaggio di microbolle a livello del setto interatriale.
Come spieghiamo un quadro del genere? L’ECG ha un aspetto “a tenda canadese”, l’ecocardiogramma è praticamente nei limiti, la troponina lievemente alterata. Per quanto improbabile, non possiamo dare per scontato che le coronarie siano normali. In particolare, ci preme escludere un eventuale dissezione coronarica post-traumatica. Coronarografia o TC cuore? Gli emodinamisti sono impegnati con un’altra urgenza mentre i radiologi sono disponibili: optiamo per una TC cuore con un pizzico di landiololo per ottenere una frequenza adeguata. Le coronarie sono indenni, senza evidenza di dissezione e con normale origine e decorso. Anche la TC conferma il lieve ispessimento della parete laterale con aumentato enhancement a tale livello. La radiologa, visto il recente politrauma, pone il sospetto di contusione miocardica.
Può una contusione spiegare un quadro del genere? Siamo dubbiosi. È strano che le alterazioni ECG si presentino a 72h dall’ingresso ed è ancor più strano che il tutto sia concomitante ad un rilascio massivo di enzimi muscolari. Inoltre, la paziente non ha riportato fratture a livello toracico e il bilancio lesionale interessa esclusivamente il bacino e gli arti inferiori.
Visto il quadro neurologico e le alterazioni elettrocardiografiche compatibili con eventuale ipertensione endocranica, viene realizzata una diagnostica con TC ed EEG che risulta negativa.
Passano i minuti e le alterazioni ECG sono sempre più marcate, la paziente non è risvegliabile e le CPK sono alle stelle. Inoltre, iniziano a verificarsi ripetuti parossismi di FA con instabilità emodinamica. Le idee iniziano a scarseggiare…
Nel sospetto di una genesi iatrogena della rabdomiolisi, i rianimatori sospendono la sedazione con il propofol e avviano terapia sostitutiva renale. Come per magia, nel corso delle 72 ore successive si assiste ad una normalizzazione delle alterazioni elettrocardiografiche e ad un progressivo miglioramento del quadro emodinamico e neurologico.
In effetti, andando a cercare su PubMed “rhabdomyolisis ECG”, il primo risultato riguarda proprio una strana sindrome correlata con l’utilizzo di propofol: la PRIS (propofol related infusion syndrome) [1]. La PRIS è una sindrome rara ma spesso fatale descritta in soggetti trattati con propofol ad alte dosi (> 4 mg/kg/h) per più di 48 ore. Si caratterizza per la comparsa di grave acidosi metabolica, rabdomiolisi, insufficienza renale ed insufficienza cardiaca [2]. I principali fattori di rischio associati al suo sviluppo sono: età giovanile, utilizzo di corticosteroidi, alti livelli di catecolamine circolanti, errori congeniti del metabolismo, nutrizione parenterale con elevato intake di lipidi e impiego di elevati dosaggi di propofol. I meccanismi fisiopatologici alla base della PRIS sono complessi e sono principalmente correlati ad un alterato metabolismo degli acidi grassi e ad un’alterata attività mitocondriale [3]. Dal punto di vista clinico, le manifestazioni cardiovascolari descritte in letteratura in corso di PRIS sono molteplici, spaziando dalle alterazioni elettrocardiografiche con aspetto “Brugada like”, alle manifestazioni aritmiche sopraventricolari e/o ventricolari, fino all’asistolia e allo shock cardiogeno.
In uno studio coordinato da Ramon Brugada è stata documentata una stretta associazione tra alterazioni elettrocardiografiche ed eventi aritmici in soggetti con PRIS. In particolare, il pattern ECG “Brugada-like” caratterizzato da sopraslivellamento ST in V1-V3 è risultato fortemente associato ad instabilità elettrica e rischio imminente di morte improvvisa [4]. Probabilmente, l’utilizzo di propofol e la presenza di fattori predisponenti (acidosi, disionie, febbre, utilizzo di altri farmaci) potrebbe portare ad una inattivazione precoce dei canali del sodio durante la fase 1 del potenziale d’azione. In questo modo, analogamente a quanto accade nei soggetti con Sindrome di Brugada, si verrebbe a creare un substrato favorevole per aritmie da rientro. Fortunatamente, nel caso della nostra paziente, non si sono verificati eventi aritmici ventricolari e le alterazioni ECG sono prontamente regredite con la clearance del farmaco.
Per quanto la spiegazione finale del caso possa apparire semplice, il quadro clinico ha generato apprensione e soltanto dopo un grande lavoro di squadra si è arrivati alla soluzione. Per chi avesse osservazioni, spunti di riflessione o esperienze da raccontare non esiti a contattarci!
Figure
Figura 1) ECG 12 derivazioni all’ingresso
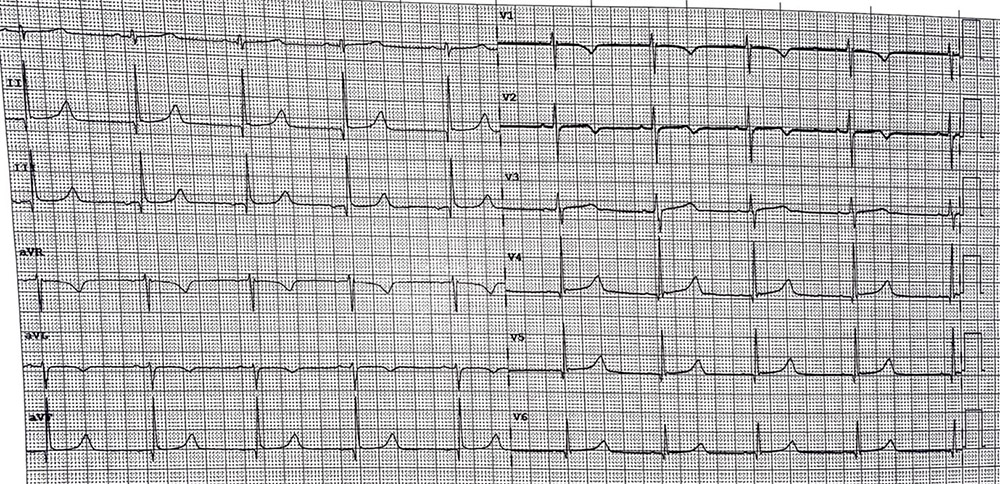
Figura 2) ECG 12 derivazioni acquisito durante il terzo giorno di degenza
Bibliografia
[1] Singh, Aayushi, Ashish P. Anjankar, and Ashish Anjankar. "Propofol-related infusion syndrome: a clinical review." Cureus 14.10 (2022).
[2] Kam, P. C. A., and D. Cardone. "Propofol infusion syndrome." Anaesthesia 62.7 (2007): 690-701.
[3] Vasile, Beatrice, et al. "The pathophysiology of propofol infusion syndrome: a simple name for a complex syndrome." Intensive care medicine 29 (2003): 1417-1425.
[4] Vernooy, Kevin, et al. "Electrocardiographic changes predicting sudden death in propofol-related infusion syndrome." Heart Rhythm 3.2 (2006): 131-137.







